Укажите формулу органического вещества:
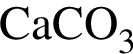
Укажите формулу органического вещества:
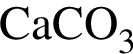
Охарактеризуйте химическую связь в молекуле бромоводорода:
а) ковалентная полярная
б) ковалентная неполярная
в) одинарная
г) двойная
Газ выделяется при добавлении избытка разбавленной серной кислоты к веществам:
а) ![]()
б) ![]()
в) ![]()
г) 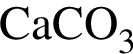
Укажите процесс, одним из продуктов которого является кислород:
В замкнутой системе протекает реакция между газообразными веществами
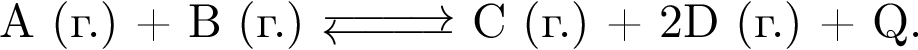
Укажите все факторы, увеличивающие скорость прямой реакции:
а — повышение давления в системе
б — понижение температуры
в — уменьшение концентрации вещества ![]()
г — уменьшение объема системы
К увеличению pH водного раствора приведет:
Укажите правильное утверждение относительно азота и фосфора:
Выберите химическое явление:
Высшую степень окисления в соединениях, равную +3, проявляет элемент:
К селитрам относятся оба вещества пары:
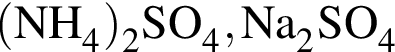
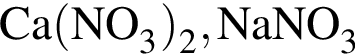
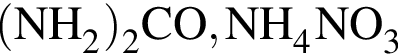
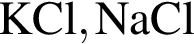
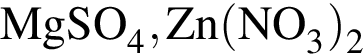
Водный раствор фенолфталеина окрасится, если к нему добавить:
Гомологи образуются при гидрировании избытком водорода углеводородов пары:
Укажите число первичных атомов углерода в молекуле 3,3–диэтилпентана:
В водный раствор гидроксида натрия пропустили углекислый газ. Укажите правильные утверждения:
а) рН раствора увеличился;
б) концентрация ионов ![]() в растворе уменьшилась;
в растворе уменьшилась;
в) рН раствора уменьшился;
г) концентрация ионов ![]() в растворе НЕ изменилась.
в растворе НЕ изменилась.
Электронная конфигурация  соответствует основному состоянию атома элемента:
соответствует основному состоянию атома элемента:
В порядке увеличения температур кипения вещества расположены в ряду:
B четырех пронумерованных пробирках находятся органические вещества.
О них известно следующее:
— при нагревании вещества в пробирке №1 с аммиачным раствором оксида серебра(I) на стенках пробирки образуется слой металлического серебра;
— при добавлении в пробирку №2 спиртового раствора иода появляется синее окрашивание,
— содержимое пробирки №4 реагирует с  с выделением газа.
с выделением газа.
Установите соответствие между названием органического вещества и номером пробирки, в которой находится указанное вещество.
А) глюкоза
Б) сахароза
В) уксусная кислота
Г) крахмал
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
— вещества из пробирок № 1 и № 4 нейтрализуют друг друга;
— вещества из пробирок № 3 и № 1 реагируют между собой с образованием голубого осадка;
— при добавлении к содержимому пробирки № 2 вещества из пробирки № 4 выпадает белый осадок.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
А) хлорид бария
Б) нитрат меди(II)
В) гидроксид натрия
Г) серная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
Составьте полные ионные уравнения реакций. Установите соответствие между реакцией и суммой коэффициентов в правой части полного ионного уравнения. Все электролиты взяты в виде разбавленных водных растворов.
A) 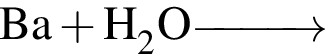
Б) 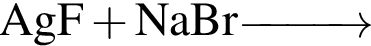
B) 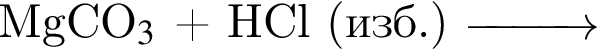
Г) 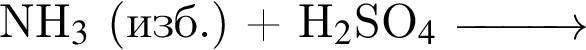
1) 1
2) 2
3) 3
4) 4
5) 5
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4В3Г5.
Определите молярную массу (г/моль) соли, полученной в результате следующих превращений органических веществ:
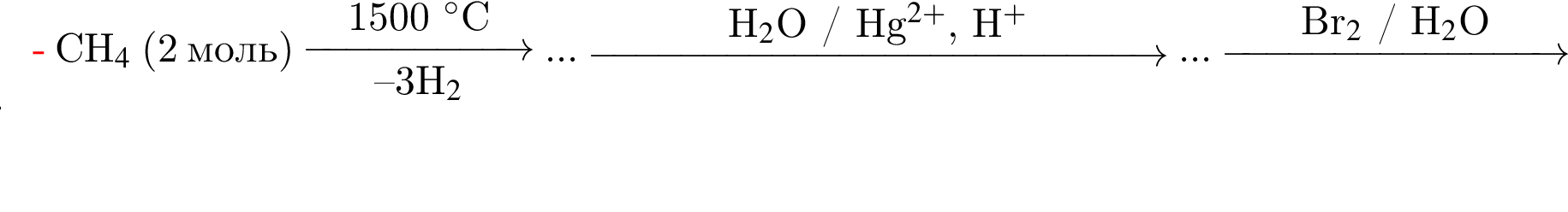
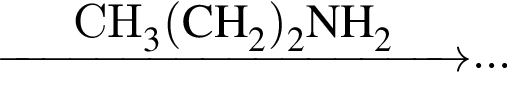
Определите сумму коэффициентов перед формулами продукта окисления и продукта восстановления в уравнении химической реакции, схема которой
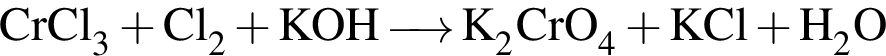
Определите сумму коэффициентов перед формулами продукта окисления и продукта восстановления в уравнении химической реакции, схема которой
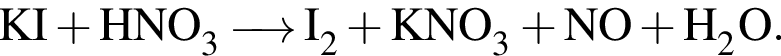
Найдите сумму молярных масс (г/моль) медьсодержащего вещества Б и азотсодержащего вещества Д (вещество Д имеет молекулярное строение) в схеме превращений
Выберите утверждения, характеризующие водород:
1) простое вещество в два раза легче гелия (н. у.)
2) атомы в молекуле связаны одинарной связью
3) взаимодействует с кислородом при поджигании с выделением большого количества теплоты
4) в реакции с этеном проявляет свойства окислителя
5) образуется в качестве основного продукта при хлорировании метана
6) ионы ![]() окисляют железо в водном растворе до степени окисления +2
окисляют железо в водном растворе до степени окисления +2
Ответ запишите в виде последовательности цифр в порядке возрастания, например: 245.
Дан перечень неорганических веществ: аммиачная селитра, графит, гидросульфит натрия, гидроксид железа(II), кремнезем, карбонат калия, оксид лития, фтор. Укажите число нерастворимых оснований, солей, высших оксидов и простых веществ соответственно.
Ответ запишите цифрами, соблюдая полученную последовательность, например: 2231.
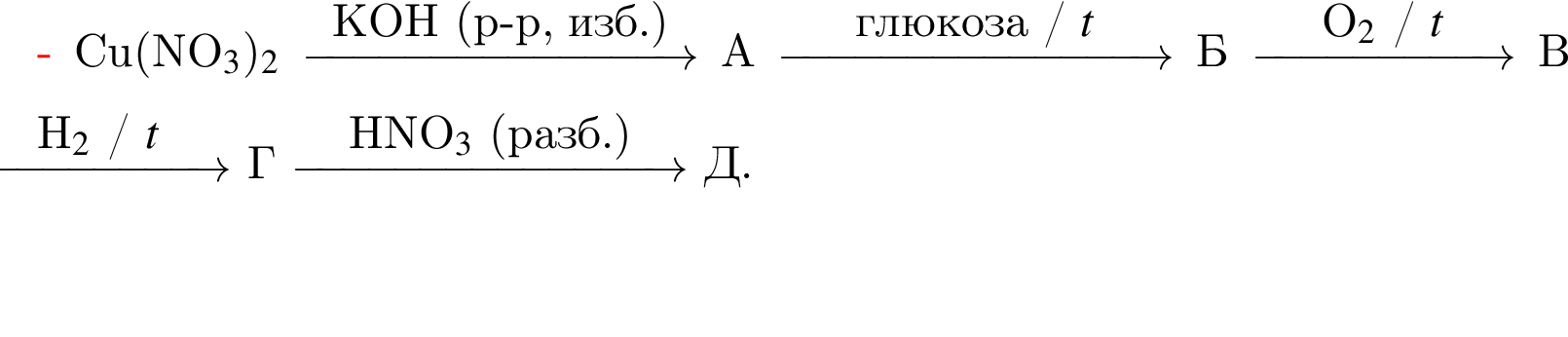
Найдите сумму молярных масс (г/моль) органических веществ ![]() и
и ![]() (вещество
(вещество ![]() имеет молекулярное строение, вещества
имеет молекулярное строение, вещества ![]() и
и ![]() — немолекулярное строение) в схеме превращений
— немолекулярное строение) в схеме превращений
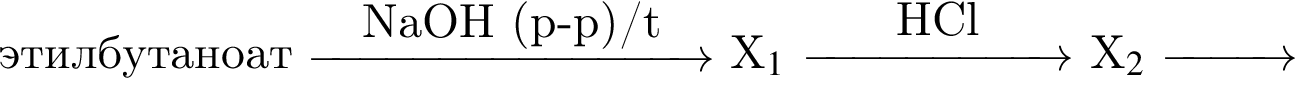
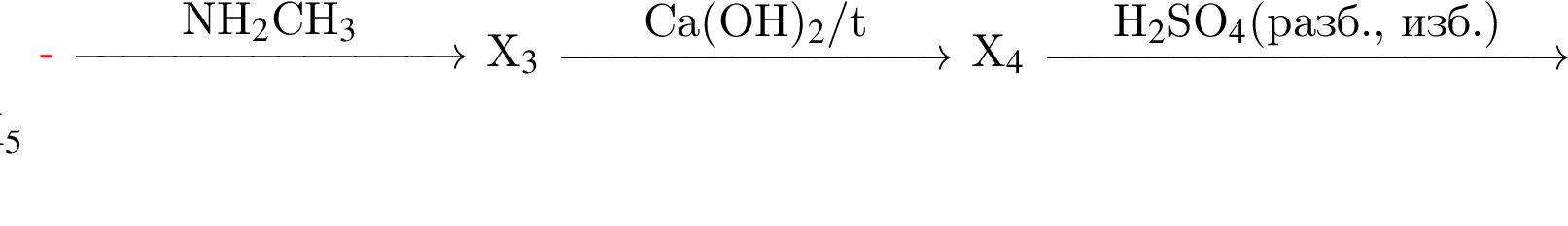
Дан перечень неорганических веществ: алмаз, гидроксид магния, гидроксид железа(II), иодид калия, кварц, натриевая селитра, оксид бериллия, хлорид меди. Укажите число высших оксидов, солей, нерастворимых оснований и простых веществ соответственно.
Ответ запишите цифрами, соблюдая полученную последовательность, например: 1322.
Определите сумму молярных масс (г/моль) азотсодержащих веществ ![]() и
и ![]() образовавшихся в результате превращений, протекающих по схеме
образовавшихся в результате превращений, протекающих по схеме
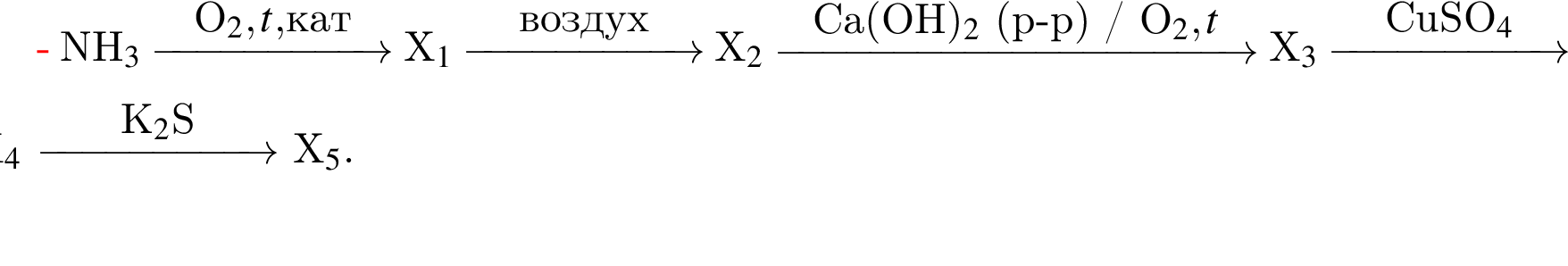
Под стеклянным колпаком при постоянной температуре в двух открытых сосудах находятся насыщенный раствор сульфата меди(II) массой 450 г и безводный сульфат натрия массой 25 г. В результате поглощения паров воды сульфат натрия превратился в кристаллогидрат состава 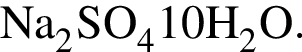 Рассчитайте массу (г) кристаллогидрата сульфата меди(II)
Рассчитайте массу (г) кристаллогидрата сульфата меди(II) 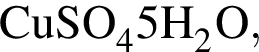 который выпал при этом в осадок. Массовая доля
который выпал при этом в осадок. Массовая доля 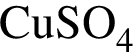 в насыщенном растворе при данной температуре составляет 18,5 %
в насыщенном растворе при данной температуре составляет 18,5 %
Установите соответствие между исходными веществами и суммой коэффициентов в сокращенном ионном уравнении реакции, протекающей между ними. Все электролиты взяты в виде разбавленных водных растворов.
A) ![]() и
и ![]()
Б) 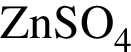 и
и ![]()
B) ![]() и
и ![]()
Г) 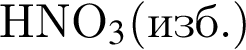 и
и 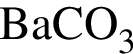
1 —6
2 —7
3 —3
4 —4
5 —5
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4В3Г5.
Выберите утверждения, верно характеризующие воду:
| 1 | молекула содержит трехвалентные атомы кислорода |
| 2 | реагирует (20°С) со всеми металлами IIA-группы |
| 3 | между молекулами существуют водородные связи |
| 4 | входит в состав глауберовой соли |
| 5 | состоит из неполярных молекул |
| 6 | валентный угол в молекуле составляет 104,5° |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 126
Дан перечень неорганических веществ: негашеная известь, оксид фосфора(V), оксид серы(VI), сернистый газ, оксид лития. Определите число веществ, которые могут реагировать с водой при комнатной температуре
Для получения веществ по схеме превращений:
![]() →
→![]() →
→ 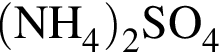 →
→ ![]() →
→ ![]()
выберите варианты из предложенных:
1 - 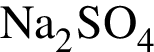
2 - ![]()
3 - ![]()
4 - 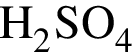
5 - ![]()
6 - ![]()
Ответ запишите цифрами в порядке следования превращений, например, 5314.
В смеси, состоящей из пропиламина, бутана и этана, массовые доли водорода и азота равны 16,4% и 15,8% соответственно. Вычислите максимальную массу (г) такой смеси, которую можно окислить газовой смесью массой 240 г, состоящей из озона и кислорода. Продуктами реакции являются только 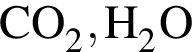 и
и ![]()
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 44,5 кДж теплоты. Полученный оксид кальция спекали с углем массой 9,6 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
Смесь, состоящая из равных химических количеств аммиака и кислорода, имеет массу 254,8 г. Найдите объем (дм3, н. у.) данной смеси.
Дано термохимическое уравнение сгорания метана:
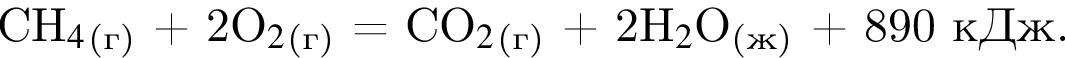
Рассчитайте, какое количество теплоты (кДж) выделится, если в реакцию вступит 40 г смеси метана и кислорода, взятых в объемном соотношении 1:2 соответственно.
В избытке воды растворили 22,5 г медного купороса, а затем — 12 г сульфида бария. Образовавшуюся смесь профильтровали, осадок отделили и высушили. Вычислите массу (г) полученного в результате эксперимента твердого остатка.